PREPARACIÓN DE UN JABÓN: SAPONIFICACIÓN
OBJETIVO
Obtener
un jabón por reacción de un aceite vegetal con hidróxido de sodio y observar
algunas de sus propiedades.
INTRODUCCIÓN
Aunque el campo principal de aplicación de las grasas y aceites se
encuentra en la industria alimentaria, desde un punto de vista industrial hay
dos aplicaciones muy importantes de los aceites: la fabricación de jabones y la
fabricación de biodiesel.
Las grasas y aceites pueden
ser de origen animal o vegetal. Químicamente son ésteres de ácidos grasos
(ácidos carboxílicos de cadena larga) y glicerina. Debido a la estructura de
sus moléculas, los aceites son conocidos como triglicéridos (o
triacilglicéridos). En la siguiente tabla se citan los ácidos grasos más
importantes constituyentes de los triglicéridos. Los cinco primeros (desde el
láurico al araquídico) son saturados porque los enlaces entre los átomos de
carbono son simples. Los seis siguientes (desde el palmitoleico al erúcico) son
insaturados porque entre átomos de carbono hay enlaces dobles (C=C). Está
comprobado que los aceites con ácidos grasos insaturados son mejores para la
salud humana.
|
Ácido graso: Nombre (nº de C) y Estructura
|
Especie en que se encuentra
|
|
Láurico (C12): CH3(CH2)10COOH
|
coco y semillas de palma
|
|
Mirístico (C14): CH3(CH2)12COOH
|
nuez moscada, coco y
semillas de palma
|
|
Palmítico (C16): CH3(CH2)14COOH
|
animales y casi todos los
aceites vegetales
|
|
Esteárico (C18): CH3(CH2)16COOH
|
animales, cacao y casi
todos los aceites vegetales
|
|
Araquídico (C20): CH3(CH2)18COOH
|
Cacahuete
|
|
Palmitoleico (C16): CH3(CH2)5CH=CH(CH2)7COOH
|
animales y vegetales
|
|
Oleico (C18): CH3(CH2)7CH=CH(CH2)7COOH
|
aceituna y almendra
|
|
Linoleico (C18): CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH
|
aceituna, girasol, soja
|
|
Linolénico (C18): CH3CH2 (CH=CHCH2)3(CH2)6COOH
|
Lino
|
|
Araquidónico (C20): CH3(CH2)4(CH=CHCH2)3CH=CH(CH2)3COOH
|
Vegetales
|
|
Erúcico (C22): CH3(CH2)7CH=CH(CH2)11COOH
|
colza, uva
|
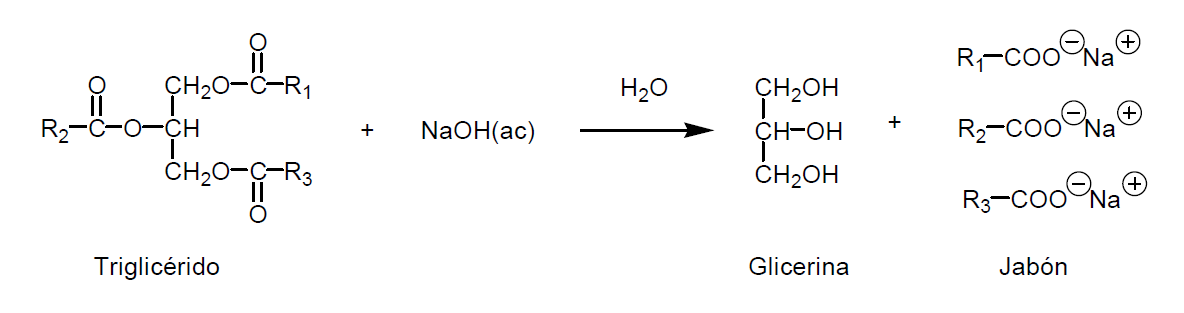
El
jabón es la sal de sodio o de potasio de un ácido graso. Como puede comprobar
en la figura, en un jabón un átomo de hidrógeno del ácido carboxílico ha sido
sustituido por un átomo de sodio. La característica principal del jabón es la
presencia en la molécula de dos zonas de distinta polaridad: una hidrófila
(grupo carboxilo) y otra lipófila (cadena de átomos de carbono).
Así, las moléculas de jabón muestran una fuerte tendencia a colocarse en
las interfases, de forma tal, que su grupo polar se encuentre dentro del agua y
su grupo apolar se encuentre orientado hacia el aire o la grasa, tal y como se
observa en la figura. Debido a esta orientación las moléculas de jabón tienen
la propiedad de disminuir la tensión superficial y por ello reciben el
nombre de sustancias tensoativas.
Como
consecuencia de esta disminución de la tensión superficial los jabones tienen
las siguientes propiedades:
- poder detergente o capacidad
para eliminar la suciedad y la grasa de
una superficie (piel, tejido etc.);
- poder emulgente o capacidad
para producir dispersiones coloidales de grasa en medio acuoso o de agua en
medio de grasa;
- poder espumógeno que da lugar a la formación de
espuma y
- actividad mojante que hace que el agua impregne
una superficie de forma homogénea.
El poder detergente del jabón se debe a que
la cadena hidrocarbonada, lipófila, disuelve las gotas de grasa, responsables
de la suciedad, y la parte polar, hidrófila, arrastra las gotas de grasa,
solubilizando el conjunto en agua y arrancando la suciedad de la superficie
manchada.
FUNDAMENTO TEÓRICO
El
jabón se obtiene por reacción de grasas animales o de aceites vegetales con una
base fuerte como la sosa, NaOH, o la potasa, KOH, aunque pueden utilizarse otras
bases. Este proceso, que da lugar a la hidrólisis de los grupos éster del
triglicérido, recibe el nombre de saponificación. Como resultado se obtiene una
molécula de glicerina (líquido) y tres moléculas de ácidos carboxílicos (los
ácidos grasos). A su vez, estos ácidos grasos reaccionan con la sosa
produciendo tres ésteres de sodio o jabones. La adición de una disolución de
cloruro de sodio (sal común) favorece la precipitación del jabón. Para la
fabricación de jabones se utilizan triglicéridos cuyos ácidos grasos tienen de
12 a 18 átomos de carbono
Una de las desventajas del jabón es que resulta un limpiador ineficaz en
aguas duras. Llamamos así a las de alto contenido en sales de magnesio, calcio
y hierro. Cuando se usa un jabón en aguas duras se forman las sales de los
ácidos carboxílicos con dichos cationes, que son insolubles y precipitan en
forma de coágulos o grumos. Por el contrario, en aguas blandas el jabón es un
adecuado agente limpiador.
Para evitar estos inconvenientes se suele añadir al jabón
sustancias que ablanden el agua. El carbonato de potasio y el fosfato de sodio
precipitan los iones magnesio, calcio, etc., en forma de carbonato y fosfato
insolubles. Desgraciadamente, estos precipitados pueden alojarse en los tejidos
dándole un color grisáceo. Por este motivo los jabones se utilizan para el aseo
personal fundamentalmente, mientras que para el lavado de la ropa se usan los
detergentes que no presentan este inconveniente. A pesar de todo, el jabón
presenta dos ventajas importantes; se obtiene de materias primas naturales y es completamente biodegradable.
Los microorganismos son capaces de metabolizar las moléculas lineales de jabón transformándolas
en agua y dióxido de carbono.
MATERIAL Y
PRODUCTOS
1 vaso de precipitados de 100 ml
1 vaso de precipitados de
250 ml
1 vaso de precipitados de
500 ml
1 varilla de vidrio gruesa
1 cuentagotas
1 embudo Buchner
1 kitasato
Tubos de ensayo y gradilla
1 placa calefactora
Papel indicador de pH
Hidróxido de sodio, NaOH
Agua destilada
Cloruro de sodio, NaCl
Aceite vegetal
EXPERIMENTACIÓN
Consultar la calculadora de saponificación (https://www.pinsapo.com/calculadora/)
para establecer las cantidades de aceite e hidróxido de sodio.
-Preparación de la disolución de hidróxido de sodio:
Pesar la cantidad necesaria de hidróxido de sodio con ayuda de un vaso de
precipitado de 100 ml. A continuación añadir la cantidad de agua indicada por
la calculadora.
-Preparación del jabón: En otro vaso de precipitados de 250
ml se colocan los 100 g de aceite y se adiciona la disolución que contiene el
hidróxido de sodio. La mezcla se calienta suavemente, agitando constantemente
con una varilla de vidrio, durante 15 minutos.
- Precipitación del jabón: La mezcla anterior se deja
enfriar y se vierte en un vaso de 500 ml que contenga una disolución fría de 20
g de cloruro de sodio en 100 ml de agua. A continuación se enfría a temperatura
ambiente y después se introduce en el congelador del laboratorio. El jabón
precipita al enfriar, se filtra a vacío con cuidado de que el poso blanco del
fondo, NaCl (de aspecto más pulverulento), no caiga sobre el büchner. Se lava
con agua fría, se seca y se realizan las pruebas indicadas a continuación.
Ensayos a realizar
Se adiciona
agua hasta la mitad de un tubo de
ensayo, y se disuelven dos espátulas del jabón preparado. Aproximadamente un
tercio de dicha disolución se vierte en otro tubo de ensayo y con él se
realizan los siguientes ensayos.
1. Se determina la alcalinidad de
la disolución de jabón con papel indicador. Si el pH es superior a 9, el jabón
es demasiado básico para ser utilizado en cualquier proceso de limpieza.
2. Se agita el tubo con la
disolución de jabón para formar espuma y se deja reposar durante 30 segundos. Se
mide el nivel de espuma formado y se anotan las observaciones.
3. Se colocan 10 gotas de aceite vegetal en dos tubos de
ensayo. Al primero se le adicionan 3 ml de agua destilada y al segundo 3 ml de
disolución de jabón. Se agitan vigorosamente los dos tubos, se dejan reposar y
se anota lo observado.


No hay comentarios:
Publicar un comentario